【ACC事後リポート】CHAMPION PHOENIX カングレロル静注でクロピドグレルを 上回る心血管イベント抑制効果示す
公開日時 2013/04/03 03:00
ステント血栓症の発生抑制効果高く 呼吸困難は増加も
経皮的冠動脈インターベンション(PCI)施行予定の患者に対する、アスピリン併用下での新規抗血小板薬・カングレロルの静注投与は、病態によらず、一貫してクロピドグレルのloadingを上回る心血管イベント抑制効果を示すことが分かった。特に、ステント血栓症の発生抑制効果が高いことも分かった。一方、出 血については2群間に有意差はみられなかったが、一時的な呼吸困難はカングレロル群で高率に発生することも分かった。二重盲検下、プラセボ対照ダブルダミー比較試験「CHAMPION PHOENIX(Cangrelor versus Standard Therapy to Achieve Optimal Management of Platelet Inhibition PHOENIX)」試験の結果から示された。3月10日に開かれたLate-breaking Clinical Trialsセッションで、研究者を代表して、Deepak L.Bhatt氏が報告した。
血については2群間に有意差はみられなかったが、一時的な呼吸困難はカングレロル群で高率に発生することも分かった。二重盲検下、プラセボ対照ダブルダミー比較試験「CHAMPION PHOENIX(Cangrelor versus Standard Therapy to Achieve Optimal Management of Platelet Inhibition PHOENIX)」試験の結果から示された。3月10日に開かれたLate-breaking Clinical Trialsセッションで、研究者を代表して、Deepak L.Bhatt氏が報告した。
PCIは、ACS患者における死亡、心筋梗塞の抑制の目的で実施されているが、手技に関連した虚血性イベントの発生も懸念されている。そのため、周術期から抗血小板療法が施行されている。欧米など海外では、アスピリンや未分画ヘパリン、グリコプロテイン(GP)Ⅱb/Ⅲa受容体拮抗薬が用いられているが、作用時間の長さやバイオアベイラビリティ(BA)の高さなどから、出血リスクが高いことも指摘されている。特に、緊急時の冠動脈バイパス術(CABG)が必要と判断された患者に対し、冠動脈造影法実施前の投与が難しいことへの課題がある。また、経口摂取に問題がある患者や、消化管吸収が不良な患者、ST上昇型心筋梗塞またはショックがあり、挿管をされている患者や吐き気がある患者に対しては、現在の抗血小板薬では限界があるのが現状だ。
カングレロルは、クロピドグレルなどと同じ作用機序である、ADP受容体拮抗薬。迅速に作用し、効果を発現する一方、可逆性で1時間以内に血小板機能が正常化することが特徴の薬剤だ。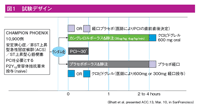
同剤は臨床第3相試験として、600mgのクロピドグレルのloading後にPCI施行中のカングレロル群とプラセボ群を比較した「CHAMPION PLATFORM(Cangrelor versus Standard Therapy to Achieve Optimal Management of Platelet Inhibition PLATFORM)」、「CHAMPION PCI(Cangrelor versus Standard Therapy to Achieve Optimal Management of Platelet Inhibition PCI)」の2試験が実施されているが、いずれも主要評価項目(CHAMPION PLATFORM:48時間以内の死亡+心筋梗塞+血管再建による虚血、CHAMPION PCI:48時間以内の全死亡+心筋梗塞+血管再建による虚血)を満たさなかった。ただ、CHAMPION PLATFORMでは、副次評価項目である、ステント血栓症を有意に減少させたほか、重大な出血の増加もみられていない。そのため、同試験はカングレロルの薬剤としての潜在的な有効性を明らかにする目的で実施された。
対象は、18歳以上の安定狭心症、非ST上昇型ACS、ST上昇型心筋梗塞患者で、P2Y12受容体拮抗薬の投与歴がなく、PCI(緊急、待機的含む)の施行が必要なアテローム性冠動脈疾患患者1万1145例。欧米など12カ国153施設からが登録された。ランダム化の7日以内前に、クロピドグレルなどのP2Y12受容体拮抗薬、abciximabなどが投与されている患者や、12時間以内に、GPⅡb/Ⅲa阻害薬のtirofiban(チロフィバン)、eptifibatide(エプチフェバチド)を投与されている患者は除外した。
①カングレロル群(カングレロル30μg/kgボーラス(bolus)投与+4μg/kg/分を2時間以上もしくはPCI施行終了まで静注+その後にクロピドグレル600mg投与)5472例②クロピドグレル群(クロピドグレル600mgまたは300mgのloading+プラセボを投与)5470例――の2群にランダムに割りつけた。なお、全例にアスピリン75~325mgを投与するほか、PCI後48時間以内はクロピドグレル75mgを投与、その後は地域のガイドラインに基づき、担当医の判断により、クロピドグレルを含めたP2Y12受容体拮抗薬の投与を可とした。また、周術期の抗凝固薬の併用も担当医の判断とした。主要評価項目は、48時間以内の死亡+心筋梗塞+血管再建による虚血+ステント血栓症。
患者背景は、平均年齢64歳、安定狭心症はカングレロル群57%、クロピドグレル群55%、非ST上昇型ACSはカングレロル群25%、クロピドグレル群26%、ST上昇型心筋梗塞はクロピドグレル群18%、クロピドグレル群19%だった。loadingについては、クロピドグレル300mgが両群ともに26%、600mgが両群ともに74%だった。
既往歴は、糖尿病がカングレロル群27.8%、クロピドグレル群28.1%、高血圧がカングレロル群80.1%、クロピドグレル群 79.4%だった。PTCA/PCIの施行はカングレロル群23.2%、クロピドグレル群 24.4%、CABGの施行はカングレロル群10.6%、クロピドグレル群 9.2%、うっ血性心不全はカングレロル群10.1%、クロピドグレル群 10.7%、末梢血管疾患(PAD)はカングレロル群8.3%、クロピドグレル群 7.1%だった。入院からPCI施行までの時間は4.4時間(中央値)、PCIの平均施行時間は、カングレロル群18(10-30)分、クロピドグレル群17(10-30)分だった。
◎ステント血栓症発生率をオッズ比で38%低下
主要評価項目の発生率は、カングレロル群4.7%(257例/5470例)、クロピドグレル群5.9%(322例/5469例)で、カングレロルの投与により、オッズ比で有意に22%低下した(オッズ比(OR):0.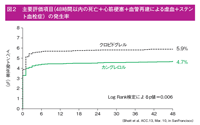 78、95%CI:0.66-0.93、p=0.005、図2)。副次評価項目のステント血栓症の発生率は、カングレロル群0.8%(46例/5470例)、クロピドグレル群1.4%(74例/5469例)で、カングレロルの投与により、オッズ比で38%の低下がみられた(OR:0.62、95%CI:0.43-0.90、p=0.01、図3)。そのほか、心筋梗塞(3.8%、4.7%、p=0.02)では有意にカングレロル群で低率だったが、血行再建による虚血(0.5%、0.7%、p=0.22)、死亡(0.3%、0.3%、p>0.99)については有意差は認められなかった。この結果は、米国とそれ以外の国(p=0.26)、基礎疾患(安定狭心症、非ST上昇型ACS、ST上昇型心筋梗塞、p=0.98)、クロピドグレルloadingの投与量の違い(p=0.62)、クロピドグレル投与のタイミング(p=0.99)によらず、一貫した結果を示した。
78、95%CI:0.66-0.93、p=0.005、図2)。副次評価項目のステント血栓症の発生率は、カングレロル群0.8%(46例/5470例)、クロピドグレル群1.4%(74例/5469例)で、カングレロルの投与により、オッズ比で38%の低下がみられた(OR:0.62、95%CI:0.43-0.90、p=0.01、図3)。そのほか、心筋梗塞(3.8%、4.7%、p=0.02)では有意にカングレロル群で低率だったが、血行再建による虚血(0.5%、0.7%、p=0.22)、死亡(0.3%、0.3%、p>0.99)については有意差は認められなかった。この結果は、米国とそれ以外の国(p=0.26)、基礎疾患(安定狭心症、非ST上昇型ACS、ST上昇型心筋梗塞、p=0.98)、クロピドグレルloadingの投与量の違い(p=0.62)、クロピドグレル投与のタイミング(p=0.99)によらず、一貫した結果を示した。
30日以内の死亡+心筋梗塞+血行再建による虚血+ステント血栓症の発生率は、カングレロル群6.0%(326例/5462例)、クロピドグレル群7.0%(380例/5457例)、ステント血栓症の発生率もカングレロル群1.3%(71例/5462例)、クロピドグレル群1.9%(104例/5457例)で、いずれもカングレロル群で有意に低下した(主要評価項目に対するOR:0.85、95%CI:0.73-0.99、p=0.03、ステント血栓症に対するOR:0.68、95%CI:0.50-0.92、p=0.01)。30日後まで効果が持続することも示された。
◎一時的な呼吸困難はカングレロル群で増加
安全性については、主要安全性評価項目である、GUSTO基準による重篤な出血は、カングレロル群0.16%(9例/5529例)、クロピドグレル群0.11%(6例/5527例)で、カングレロル群で増加する傾向はみられたが、両群間に有意差は認められなかった(OR:1.50、95%CI:0.53-4.22、p=0.44)。
1つ以上の有害事象は、カングレロル群20.2%、クロピドグレル群19.1%で有意差はみられなかったが(p=0.13)、一時的な呼吸困難は、カングレロル群1.2%、クロピドグレル群0.3%で、有意な増加がみられた(p<0.001)。
post-hoc解析による、ネットクリニカルベネフィット(有効性-安全性)は、カングレロル群で4.8%、クロピドグレル群で6.0%で。カングレロル群で有意に低下した(OR:0.80、95%CI:0.68-0.94、p=0.008)。
結果を報告したBhatt氏は、カングレロルの効果が同試験結果よりも実臨床で減弱する可能性として、▽クロピドグレルのloadingの用量が300mgよりも600mgの方が一般的である▽クロピドグレルの前治療期間が長い▽クロピドグレルではなく、プラスグレルをコントロール群で投与する――ことを挙げた。
その上で、クロピドグレルのloadingの用量については、「3/4の患者が600mgを投与されていても、統計学的に有意差をもってカングレロルのベネフィットが残っており、(クロピドグレルの増量により)減弱しなかった」と説明した。PCI施行前のクロピドグレルの投与期間については、「CREDO、PRAGUE-8の結果から、クロピドグレルの前治療による有意なベネフィットは認められていない」と指摘したほか、プラスグレルの前治療での有効性についても「最大規模の臨床試験であるACCOASTでは、データ安全性モニタリング委員会が有効性は認められず、出血が増加した」と説明し、今後のランダム化比較試験の結果で、経口薬の治療効果が明らかになることに期待感を示した。
その上で、同試験の結果から「カングレロルは、安定狭心症、非ST上昇型ACS、ST上昇型心筋梗塞を含むすべてのPCI施行患者にとって、魅力的な治療選択肢だろう」との見解を示した。
ディスカッションでは、これまでの臨床試験で有意な有効性が示せなかった原因として、周術期の心筋梗塞の診断を挙げ、バイオマーカー陽性のACSで登録後すぐに、PCIを施行した患者の再梗塞の識別が許されていなかったと説明。本試験では、「周術期の心筋梗塞は、ベースラインのバイオ―マーカーのステータスを踏まえ、注意深く診断した」と述べた。さらに、血管造影のコアラボでは、術中の合併症を診断することも可能にしたとした。そのほか、入院からPCI施行までの時間が、約7時間から約4時間に短縮したことの影響を指摘する声も聞かれた。